PERCOBAAN 8
REAKSI REDOKS
I. Tujuan Percobaan
Mempelajari beberapa reaksi redoks
II. Dasar Teori
2.1 Reaksi Kimia
Reaksi kimia adalah zat yang mula-mula terdapat dan kemudian diubah selama reaksi kimia. Suatu reaksi kimia menunjukkan umur atau lama bereaksi. Banyaknya atom diruas kiri dan kanan anak panah adalah sama. Misalnya, persamaan berimbang untuk reaksi antara H2 dan O2 yang menghasilkan air,ditulis dengan persamaan reaksi:
Rumus H2 menyatakan bahwa sebuah molekul hydrogen dari 2 atom itu adalah diatom sama seperti molekul O2. Molekul air merupakan molekul triatom karena terdiri dari 3 atom. Persamaan ini menyatakan 2 molekul H2 bereaksi dengan satu molekul O2 menghasilkan 2 molekul air.
(Keenan,1986)
2.1.1 Reaksi Redoks
Terdapat sejumlah reaksi saat keadaan oksidasi berubah yang disertai dengan pertukaran electron antara pereaksi. Ini disebut reaksi oksidasi reduksi atau reaksi redoks. Dari sejarahnya dapat diketahui bahwa oksidasi dianggap sebagai proses oksigen diambil dari suatu zat,sedangkan penangkapan hydrogen disebut reduksi.
Reaksi oksidasi adalah suatu perubahan kimia dimana suatu zat memberikan atau melepas electron,mengalami penambahan biloks/tingkat oksidasi,terjadi di anoda pada suatu sel elektrokimia. Sedangkan reaksi reduksi adalah suatu perubahan kimia dimana suatu zat menerima atau menangkap electron,mengalami pengurangan biloks,dan terjadi di katoda pada suatu sel elektrokimia.
(Svehla,1985)
2.1.2 Oksidasi dan Reduksi
Oksidasi dan reduksi dapat didefinisikan sebagai istilah berkurangnya atau bertambahnya satu atau lebih elemen. Oksidasi didefinisikan sebagai kehilangan satu atau lebih electron secara jelas oleh unsure terkecil yang terlibat dalam suatu reaksi. Sedangkan reduksi didefinisikan sebagai bertambahnya satu atau lebih electron secara jelas oleh unsure terkecil yang terdapat dalam suatu reaksi. Reaksi redoks adalah suatu reaksi transfer electron yang mana electron dari suatu unsure dioksidasi dengan kehilangan satu atau lebih electron ke unsur lain yang direduksi ketika berperan sebagai sebuah penerima electron. Jumlah electron yang hilang harus sama dengan jumlah electron yang bertambah. Dalam reaksi karena terdapat transfer satu atau lebih electron dalam satu unsur ke unsure yang lain.
Persamaan biasa:
Dalam reaksi redoks melibatkan campuran kovalen yang mana tidak terdapat transfer electron. Walauoun satu atau lebih electron valensi dibagi antara dua atom dengan pembagian pasangan electron ditarik lebih dekat ke atom yang lebih elektronegatif pada masing-masing ikatan kovalen.
(Miller,1987)
2.1.3 Oksidator dan Reduktor
Reduktor adalah zat yang mengalami oksidasi. Sedangkan oksidator adalah zat yang mengalami reduksi.
2.2 Bilangan Oksidasi
Dalam reaksi redoks ada perbedaan dalam bilangan oksidasi atau keadaan oksidasi. Istilah ini digunakan untuk memperlihatkan sesuatu yang saling mengubah dari dua atau lebih unsur. Misalnya reaksi antara magnesium dengan oksigen:
Terlihat bahwa biloks Mg berubah dari 0 menjadi +2 dan bilangan oksidasi oksigen berubah dari 0 menjadi -2. Dengan demikian, oksidasi Mg diikuti dengan bertambahnya biloks. Reduksi O2 sebaliknya diikuti dengan berkurangnya biloks. Dengan demikian,hal ini memberikan kepada kita cara lebih umum untuk mendefinisikan oksidasi dan reduksi berkaitan dengan perubahan dalam bilangan oksidasi dan reduksi.
(Brady,1994)
2.3 Penyetaraan Reaksi Redoks
Banyak reaksi redoks yang sulit disetarakan dengan cara menebak. Reaksi seperti itu dapat disetarakan dengan metode setengah reaksi ataupun bilangan oksidasi. Metode setengah reaksi atau metode ion elektron in didasarkan pada pengertian jumlah elektron yang dilepaskan pada setengah reaksi redoks. Proses penyetaraan in berlangsung melalui tahap-tahap sebagai berikut :
Contoh : K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O
Langkah I : menulis kerangka dasar dari dari setengah reksi oksidasi dan setengah reaksi reduksi secara terpisah dalam bentuk ion.
Oksidasi : Cl- → Cl2
Reduksi : Cr2O72- → 2Cr3+
Langkah II : masing-masing setengah reaksi tersebut disetarakan agar jumlah atom sebelah kiri sama dengan sebelah kanan.
Oksidasi : 2Cl- → Cl2
Reduksi : Cr2O72+ + 14H+ → 2Cr3+ + 7H2O
Langkah III : jika ada spesies lain selain unsur yang mengalami perubahan bilanagna oksidasi O2 dan H2, maka penyetaraannya dengan menambahkan spesies yang bersangkutan pada ruas yang lainnya.
Dalam reaksi in tidak ada.
Langkah IV : menyetarakan muatan denangan menambahkan elektron pada ruas yang jumlah muatannya lebih besar.
Oksidasi : 2Cl- → Cl2 +2e-
Reduksi : Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Langkah V : menyetarakan jumlah elektron yang diserap pada setengah reaksi reduksi dengan elektron tinggi yang dibebaskan pada setengah reaksi oksidasi denagn cara memberi koefisien yang sesuai kemudian menjumlahkan kedua setengah reaksi tersebut.
Reaksi redoks yang setara :
Persamaan reaksi ion tersebut sudah dianggap cukup. Apabila diperlukan, reaksi redoks yang setara dapat ditunjukkan dari reaksi ionnya sehingga menjadi :
K2CrO7 + 14 HCl → 2 CrCl3 + 3Cl2 + 2KCl + 7H2O
(Petrucci, 1992)
2.4 Reaksi Disproporsionasi
Reaksi disproporsionasi adalah reaksi redoks yang terjadi simultan oleh suatu spesies. Spesies ini mengandung unsur yang mempunyai bilangan oksidasi diantara bilangan oksidasi tertinggi dan terendah. Atau denagn kata lain, suatu jenis atom ytang mengalami redoks atau suatu jenis atom yang bilangan oksidasinya berubah. Reaksi disproporsionasi disebut juga reaksi autoredoks.
Contoh :
a. Cl2(g) + 2OH-(aq) → ClO-(aq) + Cl-(aq) + H2O(l)
b. 2H+(aq) + 3NO2(aq) → NO3(aq) + 2NO(g) + H2O(l)
(Lange, 1967)
2.5 Pendesakan Logam
Unsure logam cenderung mengalami oksidasi (melepas electron), sehingga semua logam bersifat reduktor. Ada sebagian logam yang bersifat reduktor kuat dan reduktor lemah (mudah teroksidasi).
Reduktor kuat sampai lemah :
Li, K, Ba, Ca, Na, Mg, Al, Mn, H2O2, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H+, Sb, Bs, Cu, Hg, Ag, Pb, Au.
Deret volta tersbut, semakin ke kanan sifat reduktornya makin kuat dan oksidasinya makin lemah. Oleh karena itu, anggota deret volta yang lebih ke kanan melalui reduksi. Reaksi ini disebut reaksi pendesakan logam.
(Rivai,1995)
2.6 potensial elektroda
Potensial elektroda Ɛº dapat diukur dalam larutan yang mengandung bentuk pengoksidasi dan pereduksi dalam konsentrasi yang ekuimolar. Elektroda standar yakni yang bersentuhan dengan larutan-larutan yang kadar ionya 1M dan tekanan 1 atm. Pengukuran suatu sel volta adalah pengukuran gaya dorong dari reaksi redoks. Elektroda hydrogen standar digunakan sebagai elektroda pembanding standar karena harga voltanya nol. Potensial elektroda standar diukur secara langsung, namun potensial antara dua elektroda standar ideal dapat dihitung dari pengukuran yang dilakukan terhadap larutan yang lebih encer.
Voltage sel keseluruhan diberikan kepada elektode disebut potensial reduksi standar. Reaksi katode(reduksi) kebalikan dan elektroda yang sebagai anode dan menjalankan oksidasi.
(keenan,1991)
Table Potensial Reduksi.
Li+(aq) + e- -----> Li(s)
|
-3.05
|
|
K+(aq) + e- -----> K(s)
|
-2.93
|
|
Ba2+(aq) + 2 e- -----> Ba(s)
|
-2.9
|
|
Sr2+(aq) + 2 e- -----> Sr(s)
|
-2.89
|
|
Ca2+(aq) + 2 e- -----> Ca(s)
|
-2.87
|
|
Na+(aq) + e- -----> Na(s)
|
-2.71
|
|
Mg2+(aq) + 2 e- -----> Mg(s)
|
-2.37
|
|
Be2+(aq) + 2 e- -----> Be(s)
|
-1.85
|
|
Al3+(aq) + 3 e- -----> Al(s)
|
-1.66
|
|
Mn2+(aq) + 2 e- -----> Mn(s)
|
-1.18
|
|
2 H2O + 2 e- -----> H2(g) +
2
|
-0.83
|
|
Zn2+(aq) + 2 e- -----> Zn(s)
|
-0.76
|
|
Cr3+(aq) + 3 e- -----> Cr(s)
|
-0.74
|
|
Fe2+(aq) + 2 e- -----> Fe(s)
|
-0.44
|
|
Cd2+(aq) + 2 e- -----> Cd(s)
|
-0.4
|
|
PbSO4(s) + 2 e- -----> Pb(s)
+ SO42-(aq)
|
-0.31
|
|
Co2+(aq) + 2 e- -----> Co(s)
|
-0.28
|
|
Ni2+(aq) + 2 e- -----> Ni(s)
|
-0.25
|
|
Sn2+(aq) + 2 e- -----> Sn(s)
|
-0.14
|
|
Pb2+(aq) + 2 e- -----> Pb(s)
|
-0.13
|
|
2 H+(aq) + 2 e- -----> H2(g)
|
0
|
|
Sn4+(aq) + 2 e- -----> Sn2+(aq)
|
0.13
|
|
Cu2+(aq) + e- -----> Cu+(aq)
|
0.13
|
|
SO42-(aq) + 4 H+(aq)
+ 2 e- -----> SO2(g) + 2 H2O
|
0.2
|
|
AgCl(s) + e- -----> Ag(s) +
Cl-(aq)
|
0.22
|
|
Cu2+(aq) + 2 e- -----> Cu(s)
|
0.34
|
|
O2(g) + 2 H2 + 4 e- -----> 4
|
0.4
|
|
I2(s) + 2 e- -----> 2 I-(aq)
|
0.53
|
|
MnO4-(aq) + 2 H2O +
3 e- -----> MnO2(s) + 4
|
0.59
|
|
O2(g) + 2 H+(aq) + 2 e-
-----> H2O2(aq)
|
0.68
|
|
Fe3+(aq) + e- -----> Fe2+(aq)
|
0.77
|
|
Ag+(aq) + e- -----> Ag(s)
|
0.8
|
|
Hg22+(aq) + 2 e-
-----> 2 Hg(l)
|
0.85
|
|
2 Hg2+(aq) + 2 e- -----> Hg22+(aq)
|
0.92
|
|
NO3-(aq) + 4 H+(aq)
+ 3 e- -----> NO(g) + 2 H2O
|
0.96
|
|
Br2(l) + 2 e- -----> 2 Br-(aq)
|
1.07
|
|
O2(g) + 4 H+(aq) + 4 e-
-----> 2 H2O
|
1.23
|
|
MnO2(s) + 4 H+(aq) + 2 e-
-----> Mn2+(aq) + 2 H2O
|
1.23
|
|
Cr2O72-(aq) + 14 H+(aq)
+ 6 e- -----> 2 Cr3+(aq) + 7 H2O
|
1.33
|
|
Cl2(g) + 2 e- -----> 2 Cl-(aq)
|
1.36
|
|
Au3+(aq) + 3 e- -----> Au(s)
|
1.5
|
|
MnO4-(aq) + 8 H+(aq)
+ 5 e- -----> Mn2+(aq) + 4 H2O
|
1.51
|
|
Ce4+(aq) + e- -----> Ce3+(aq)
|
1.61
|
|
PbO2(s) + 4 H+(aq) + SO42-(aq)
+ 2 e- -----> PbSO4(s) + 2 H2O
|
1.7
|
|
H2O2(aq) + 2 H+(aq)
+ 2 e- -----> 2 H2O
|
1.77
|
|
Co3+(aq) + e- -----> Co2+(aq)
|
1.82
|
|
O3(g) + 2 H+(aq) + 2 e-
-----> O2(g) + H2O
|
2.07
|
|
F2(g) + 2 e- -----> F-(aq)
|
2.87
|
2.7 Indikator Redoks
Merupakan senyawa organik yang mempunyai sifat berbalik perubahan warnanya
apabila oksidasi maupun reduksi.
αn oksidasi + n ê = n reduksi
Keterangan:
αn oksidasi : bentuk teroksidasi dari
indikator
αn reduksi : bentuk tereduksi dari indikator
Potensial elektrodanya adalah:
2.8 Penentu Potensial Elektroda
Jika ∑0 adanya positif, maka reaksi ke kanan akan terjadi seperti yang ditulis dalam tabel elektroda akan bertindak sebagai katode dari elektrode hidrogen sebagai anode. Jika tanda ini negatif, reaksi ke kiri akan berlangsung sertamerta dan elektrode hidrogen akan bertindak sebagai katode (mengambil reduksi) bila sebuah elektrode hidrogen.
a. bertindak sebagai katode, reaksinya adalah
2H+ + 2ê → H2 (reduksi)
b. bertindak sebagai anode, reaksinya adalah
H2 → 2H+ + 2ê (oksidasi)
Potensial reduksi bertambah untuk lithium sampai flou. Ini berarti bahwa terdapat kecenderungan yang meningkat dan atas ke bawah untuk memperoleh ê (mengalami reduksi) dan kecenderungan yang melepas ê (mengalami oksidasi). Volta sel merupakan jumlah aljabar dari potensial oksidasi dan potensial reduksi.
Voltase standar untuk sel:
E0 sel : E0 reduksi+ E0 oksidasi
Jika voltase sel yang dihitung itu positif, reaksi sel itu akan berlangsung serta merta.
(Keenan,1986)
2.9 Agen-Agen Pengoksidasi
Agen-agen pengoksidasi adalah zat yang mengambil elektron dari zat yang dioksidasi, denagn cara itu menyebabkan terjadinya oksidasi.
(Brady, 1999)
2.9.1 Natrium dan hidrogen peroksida (Na dan H2O2)
Hidrogen peroksida (H2O2) adalah senyawa pengoksidasi yang baik dengan potensial standar positif yang besar.
H2O2 + 2H+ +2e- ↔ 2H2O E° = +1,77 V
Dalam larutan yang bersifat asam, senyawa in akan mengoksidasi Fe2+ menjadi Fe3+. Dalam larutan alkali, akan mengoksidasi Cr3+ menjadi Cr2O72- dan Mn2+ menjadi MnO2.
2.9.2 Kalium dan amonium proksedisulfat
Ion peroksedisulfat adalah senyawa pengoksidasi yang kuat dalam larutan yang bersifat asam.
S2O22- + 2e- ↔ 2SO42- E° = +2,01V
Senyawa in akan mengoksidasi Cr3+ menjadi Cr2O72-, Ce3+ menjadi Ce4+ dan Mn2+ menjadi MnO4-. Reaksi biasanya dikatalis oleh sejumlah kecil ion perak (I), setelah oksidasi selesai, kelebihan regen dapat dihilangkan dengan mendidihkan larutan.
2S2O22- + 2H2O ↔ 4SO42- + O2 +4 H+
2.9.3 Kalium permanganat
Keuntungan kalium permanganat adalah mudah diperoleh, tidak mahal, dan tidak perlu indikator tertentu, kecuali pada laritan yang amat encer.
Reaksi :
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
2.9.4 Senyawa-senyawa dari Serium
Senyawa ini merupakan agen pengoksidasi yang kuat dan menkjalani reaksi tunggal.
Reaksi :
Ce4+ + e- → Ce3+
2.9.5 Kalium dikromat
Kalium dikromat merupakan pengoksidasi yang kuat.
Reaksi :
Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O
2.9.6 Iodin
Iodin merupakan pengoksidasi yang kuat.
Reaksi :
I2 + 2e- → 2I-
2.9.7 Asam perodat
Senyawa asam paraperiodat (H5IO6) merupakan agen pengoksidasi yang kuat.
Reaksi :
H5IO6 + 6H+ + 2e- → IO3- + 3H2O
2.9.8 Kalium bromat
Merupakan agen pengoksidasi yang kuat.
Reaksi :
BrO3- + 6H+ + 6e- → Br- + 3H2O
2.9.9 Brimustat
Merupakan agen pengoksidasi yang kuat, mengoksidasi Mn(II) menjadi MnO4-, Cr (II) menjadi Cr2O72-, dan Cr (II) menjadi Cr (IV), Brimustat direduksi menjadi Bi (III)
(Underwood, 1992)
2.10 Agen Pereduksi
Agen-agen pereduksi adalah zat yang memeberi electron pada suatu zat lainnya yang direduksi dengan cara menyebabkan terjadinya reduksi
(Brady,1999)
1. Sulfur dioksida dan hydrogen sulfide
Kedua zat tersebut merupakan agen-agen pereduksi yang relatif lambat
2. Timah (II) Klorida
Reagen ini digunakan untuk mereduksi Fe3+ menjadi Fe2+ dalam sampel yang telah dilarutkan dalam HCl
(Brady,1999)
3. Ion Tiosulfat (S2O32-)
Ion tiosulfat bila direaksikan dengan oksidator kuat maka S2O32- akan teroksidasi menjadi ion sulfat (SO42-) misalnya bila gas klor dialirkan pada larutan Na2SO4 , maka akan terjadi reaksi:
4Cl2 + S2O32- + 5H2O 8Cl¬- + 2SO42- + 10H+
(Brady,1999)
4. Besi (II)
Larutan besi(II) dalam 0,5-1 N H2sO4 dioksidasi secara lambat dan dipergunakan sebagai larutan standar . Larutan permanganate, serium(IV), dan dikromat cocok dalam titrasi larutan besi (III)
5. Kromium(II)
Kromium merupakan agen pereduksi yang kuat
Reaksi:
CFr3+ + e Cr2+ E0 = -0,14V
(Brady,1999)
6. Titanium(III)
Adalah agen pereduksi yang kuat yang berasal dari garam-garamnya.
Reaksi:
TiO2+ +2H+ + e Ti3+ + H2O E0=+0.104V
7. Oksalat dan arsenic(III)
Larutan standar asam oksalat cukup stabil larutan standar dari sodium oksalat lebih baik, tidak stabil.
(Brady,1999)
8. Sulfit dan bisulfit
Garam0garam yang mengandung ion sulfat atau bisulfit biasanya dipakai sebagai reduktor. Anionnya didapat dari netralisasi asam sulfat sebagian atau seluruhnya. Bila suasananya basa, maka pereaksinya menjadi ion sulfat, baik untuk zat yang asalnya mengandung ion sulfuit ataupun bisulfit.
(Brady,1999)
2.11 Analisa Bahan
1. CuSO4
Berwarna biru dan bersifat Higroskopis, digunakan sebagai fungisada, bahan pewarna dan pengawet kayu
(Sarjoni, 2003)
2. Logam Alumunium
Berat atom 26,9315 , Tititk lebur 6600C dan titik didih 24500C , ringan dan berwarna keperakan. Digunakan dalam industry pembuatan pesawat terbang, alat rumah tangga, merupakan konduktor yang baik
(Sarjoni,2003)
3. Logam Zn
Berwarna putih kebiruan, tidak larfut dalam air dan larut dalam larutan asam sulfat
(Sarjoni, 2003)
4. Logam Cu
Berat atom 63,564. Merupakan konduktor yang baik dan tahan karat
Sarjoni, 2003)
5. Pb(NO3)2
Kristalnya berwarna putih, beracun, larut dalam air, alcohol, dan methanol
(Sarjoni, 2003)
6. Logam Fe
Bersifat magnet dan lunak. Terdapat di alam dalam bentuk karbonan sulfide
(The Merck Index,1976)
7. NaNO3
Memiliki berat molekul 85,04, tidak berwarna, kristalnya bening, butiran atau bubuknya berwarna putih. Titik leburnya 3080C, Larutannya bersifat netral
(The Merck Index,1976)
8. H2O2
Berat molekulnya 34,02 tidak berwarna, kurang stabil, dapat membakar kulit. Tititk lebur -0,430C titik didih 1520C, dapat larut dalam eter, mamapu diuraikan oleh beberapa pelarut organic.
(The Merck Index,1976)
9. MnO2
Warnanya hitam, berbentuk Kristal, tidak larut dalam air, berfungsi sebagai katalis
(Parker,1986)
10. H2SO4
Berbentuk cair, berminyak, berwarna cokelat gelap, sangat korosif, beracun, dapat menyebabkan iritasi pada mata dan kilit, mampu melarutkan semua logam.
(Sarjoni 2003)
11. KI
Berat molekul 116,02 berwarna putih, kristalnya berbentuk kubus, butiran atau bubuknya berwarna putih, dapat larut dalam air, alcohol, methanol, aseton, gliserol dan glikol.
(The Merck Index,1976)
12. ZnSO4
Merupakan Kristal putih, deret volta 1,9 larut dalam air Digunakan sebagai skiptik
(Basri,1996)
13. Zn(NO3)2
Berupa larutan tidak berwarna, Larut dalam air dan alcohol,, tidak berbau, bersifat asam, keasaman 5% adalah 5,1. Massa molekul 189,35 titik leleh 360C Densitas 2,065
(Basri1996)
14. FeCL3
Berupa Kristal berwarna cokelat, Lrut dalam ait, alcohol dan gliserol.
(Basri, 1996)
15. Kanji
Karbohidrat berwarna putih, tanpa bau, tanpa rasa, dan sangat penting bagi tumbuhan, dihasilkan melalui proses fotosintesis. Adanya kanji dapat dibuktoikan dengan iodine
(Basri,1996)
III. METODE PERCOBAAN
3.1 Alat dan Bahan
a. Alat
-Tabung reaksi
-Gelas ukur
-Kertas amplas
-Pipet
-Tabung spirtus
-Penjepit
-Kaki tiga
-Gelas beker
b. Bahan
-CuSO4 -Pb(NO3)
-ZnSO4 -Logam Zn -Logam Cu -Logam Al -Logam Fe -FeCl3
-Pb(NO3)2 -NaNO3
-H2SO4 -KI
-Kanji -MnO2
3.2 Gambar Alat
IV. DATA PENGAMATAN
Perlakuan
|
Pengamatan
|
keterangan
|
2 mL larutan CuSO4 0,5 M
ditambah logam Zn
2 mL larutan ZnSO4 0,5 M
ditambah Cu
Pb(NO3)2 + Al
Zn(NO3)2 + Al
NaNO3 +Al
Pb(NO3)2 + Fe
Zn(NO3)2 + Fe
NaNO3 +Fe
Pb(NO3)2 + Cu
Zn(NO3)2 + Cu
NaNO3 +Cu
10 tetes H2O2 0,1
M direaksikan dengan MnO2
5 tetes H2O2 0,1 M
direaksiakan dengan H2SO4, KI dan larutan Kanji
5 tetes FeCl3, 10 tetes H2SO4
1 M, 10 tetes KI o,1 M dipanaskan
Penambahan 1 tetes larutan Kanji
|
Timbul gelembung gas
Zn hancur.
Tidak ada gelembung di logam Cu
Timbul gelembung pada logam Al
Timbul gelembung pada logam Al
Tidak ada gelembung di logam Al
Timbul gelembung pada logam Fe
Tidak ada gelembung di logam Fe
Tidak ada gelembung di logam Fe
Tidak ada gelembung di logam Cu
Tidak ada gelembung di logam Cu
Tidak ada gelembung di logam Cu
Ada gelembung gas
Terbentuk warna ungu dan muncul gas
sesudah pemanasan
Setelah dipanaskan berwarna orange, lalu
diberi kanji menjadi hitam.
|
(+)
(-)
(+)
(+)
(-)
(+)
(-)
(-)
(-)
(-)
(-)
(+)
(+)
(+)
|
V. PEMBAHASAN
Percobaan reaksi redoks ini bertujuan untuk mempelajari reaksi-reaksi redoks. Prinsip yang digunakan dalam percobaan ini adalah transfer elektron dan perubahan bilangan oksidasi. Sedangkan metode yang digunakan dalam reaksi redoks adalah reaksi pendesakan logam dan reaksi disproporsionasi.
5.1 Mencampurkan logam Zn kedalam larutan CuSO4
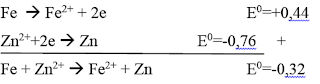
Dalam tahap ini,dilakukan pencampuran antara logam Zn dengan CuSO4. Larutan CuSO4 yang berwarna biru ditambah dengan logam Zn lalu dipanaskan berubah menjadi biru muda.Fungsi pemanasan yaitu untuk mempercepat reaksi karena pemansan dapat mempercepat pencapaian energi aktivasi.Terbentuk logam Cu yang hancur menjadi serbuk-serbuk berwarna coklat dan mengendap,serta terjadi gelembung-gelembung gas yang menandakan terjadinya reaksi. Pencampuran ini dilakukan agar terjadi reaksi redoks. Reaksinya yaitu:
(Svehla,1985)
Dalam larutan CuSO4 dan logam Zn terjadi reaksi redoks. Logam Zn membentuk reaksi oksidasi menjadi Zn2+,sedangkan Cu2+ mengalami reduksi menjadi Cu. Reaksi oksidasi adalah suatu proses yang menyebabkan hilangnya elektron, sedangkan redusi adalah proses yang menyebabkan hilangnya bertambahnya elektron.
Dari reaksi tersebut dapat dilihat bahwa reaksi antara CuSO4 dengan Zn mempunyai potensial standar sebesar =+1,10 (bernilai positif), maka reaksi dapat berlangsung spontan.
5.2 larutan ZnSO4 ditambahkan logam Cu
Pada percobaan ini tidak terjadi perubahan warna larutan, tidak adanya perubahan warna menandakan bahwa reaksi tidak berlangsung. Tidak muncul sedikitpun gelembung pada logam Cu. Reaksinya adalah:
Larutan ZnSO4 dan Cu tidak bereaksi karena pada deret volta Zn bereda disebelah kiri Cu, maka Zn tidak dapat mereduksi Cu dasarkan deret volta. Logam yang berada disebelah kirinya tidak dapat mereduksi.
Karena potensial reduksinya hasilnya negatif maka reaksi tidak berlangsung secara spontan.
5.3.1 reaksi Pb(NO3)2 dengan logam Al
Dalam percobaan ini, logam Al mengalami oksidasi, muncul gelembung gas pada logam Al yang merupakan gas O2 dan gas H2 ketika logam Al dimasukan kedalam larutan Pb(NO3)2 dan dipanaskan. Logam Al mengalami oksidasi menjadi Al3+ yang hancur sedikit demi sedikit. Adanya gelembung pada logam Al menendakan terjadinya oksidasi.
Reaksi antara Pb2+ dengan Al3+:
Karena potensial reduksinya bernilai positif maka reaksinya terjadi secara spontan.
5.3.2 reaksi antara Zn(NO3)3 dengan logam Al
Pada percobaan ini terdapat gelembung gas yang keluar dari logam Al, gelembung tersebut menendakan reaksi berlangsung spontan namun terjadi dalam waktu lama. Hal ini menandakan kemampuan reduksinya kecil.
Reaksinya adalah:
Karena hasilnya positif maka terjadi reaksi spontan.
5.3.3 reaksi antara NaNO3 dengan logam Al
Pada percobaan ini tidak terdapat perubahan ,sehingga reaksi negative. Reaksi antara Al dengan Na tidak spontan karena Al tidak dapat mereduksi Na+ karena kemampuan reduksi Na lebih besar dari Al.
Reaksinya adalah:
Karena potensial reduksinya negatif maka tidak terjdi reaksi spontan.
5.3 Reaksi antara Pb(NO3),Zn(NO3)2,dan NaNO3 dengan logam Fe
• Besi dengan larutan Pb(NO3)2
Pada percobaan ini besi yang telah di ampelas di masukkan ke dalam larutan Pb(NO3)2 0,5M, kemudian dipanaskan. Fungsi pemanasan adalah untuk mempercepat terjadinya reaksi karena saat pemanasan partikel-partikel dalam larutan akan bergarak lebih cepat sehingga tumbukan lebih sering terjadi dan reaksi dapat berjalan lebih cepat.
Pada percobaan ini terlihat bahwa setelah pemanasan terdapat gelembung-gelembung gas yang menandakan bahwa terjadi reaksi.
Berdasarkan perhitungan E0sel dapat dilihat bahwa diperoleh hasil yang positif hal ini sesuai dngan percobaan bahwa dapat terjadi reaksi anatara Fe dengan Pb(NO3)2
Reaksi:
Pada percobaan ini besi yang telah di ampelas di masukkan ke dalam larutan Zn(NO3)2 0,5M, kemudian dipanaskan. Fungsi pemanasan adalah untuk mempercepat terjadinya reaksi karena saat pemanasan partikel-partikel dalam larutan akan bergarak lebih cepat sehingga tumbukan lebih sering terjadi dan reaksi dapat berjalan lebih cepat.
Setelah dilakukan pemanasan tidak terdapat perubahan/gelembung gas pada seng, hal ini menunjukkan bahwa tidak terjadi reaksi.
Berdasarkan hasil perhitungan E0Sel di atas diperoleh nilai yang negatif hal ini menunjukkan bahwa reaksi tidak dapat berjalan dengan spontan/ tanpa diberi energi.
Pada percobaan ini besi yang telah di ampelas di masukkan ke dalam larutan Zn(NO3)2 0,5M, kemudian dipanaskan. Fungsi pemanasan adalah untuk mempercepat terjadinya reaksi karena saat pemanasan partikel-partikel dalam larutan akan bergarak lebih cepat sehingga tumbukan lebih sering terjadi dan reaksi dapat berjalan lebih cepat.
Setelah dilakukan pemanasan tidak terdapat perubahan/gelembung gas pada seng, hal ini menunjukkan bahwa tidak terjadi reaksi.
5.3.2 Reaksi antara Pb(NO3)2, Zn(NO3)2, dan NaNO3 dengan logam tembaga Cu
Logam Cu dimasukkan pada masing-masing larutan Pb(NO3)2, Zn(NO3)2, dan NaNO3, kemudian dipanaskan untuk mempercepat terjadinya reaksi. Hasil yang diperoleh dari ketiganya, yaitu tidak terbentuk gelembung gasO2 dan gas H2. Hal ini membuktikan bahwa tidak adanya gejala-gejala yang menunjukkan terjadinya reaksi redoks. Ini terjadi karena letak Cu pada deret volta berada di sebelah kanan logam Pb, Zn, dan Na, sehingga Cu tidak dapat mendesak logam Pb, Zn, maupun Na.
Reaksi-reaksi yang terjadi :
(Svehla,1985)
Hasil EO sel negatif menunjukkan bahwa reaksi tidak berlangsung secara spontan.
5.4 Reaksi H2O2 dengan MnO2
Larutan H2O2 0,1 M direaksikan dengan MnO2,penggunaan MnO2 disini berfungsi sebagai katalisator untuk mempercepat reaksi.Setelah penambahan MnO2 kemudian larutan dipanaskan,pemanasan dilakukan untuk menguraikan H2O2 menjdi H2O dan O2.Fungsi pemanasan yang lain adalah untuk mempercepat terjadinya penguraian H2O2. Dengan dilakukannya pemanasan gerakan molekul-molekul H2O2 akan menjadi semakin cepat sehingga tumbukan antar molekul H2O2 dengan MnO2 menjadi lebih sering. Hal ini akan menyebabkan H2O2 cepat bereaksi dengan MnO2 sehingga H2O2 akan lebih cepat terurai menjadi H2O dan O2. Ketika dilakukan pemanasan timbul gelembung-gelembung kecil pada dinding tabung. Gelembung-gelembung kecil ini adalah O2 ¬yang terbentuk dari reaksi H2O¬¬2. reakssi yang terjai adalah :
(Chang,2005)
Reaksi diatas merupakan reaksi disproporsionasi , yaitu reaksi yang terjadi bila beberapa senyawa pada keadaan intermediet bereaks membentuk spesies dengan bilangan oksidasi yang berbeda. Reaksi ini juga disebut dengan reaksi autoredoks yaitu suatu spesies bertindak sebagai reduktor dan oksidator.
5.5 Reaksi antsara H2O2, H2SO4, dan KI dengan larutan amilum
Reaksi ini bertujuan untuk membuktikan terjadinya reaksi redoks antara H2O2, H2SO4, dan KI. Ketika H2O2 ditambahkan dengan H2SO4 warna larutan berwarna putih bening.H2O2 merupakan oksidator yang berfungsi sebagai donor ion H+ Penambahan H2SO4 berfungsi untuk memberikan suasana asam agar terjadi reaksi antara H2O2 dengan KI. Lalu ditambahkan larutan KI dan terjadi perubahan warna menjadi kuning muda.KI berfungsi sebagai indicator karena KI apabila tereduksi menjadi I2 yang berwarna ungu pada larutan. Kemudian larutan tersebut ditambahkan amilum yang bertujuan sebagai indikator redoks untuk membuktikan adanya I2 sebagai hasil produk reaksi. Setelah ditambahkan amilum dalam bentuk larutan,larutan berubah warna menjadi warna ungu yang menunjukkan bahwa adanya iodin (I2) dalam produk. Kemudian larutan dipanaskan. Setelah pemanasan larutan menjadi kuning. Hal ini terjadi karena amilum yang terdapat di dalam larutan rusak akibat dari pemanasan.
(Miller, 1987)
5.6 Reaksi antara FeCl3, H2SO4, KI dan laruan amilum
FeCl3 ditambahkan H2SO4 terbentuk warna kuning. FeCl3 sebagai oksidator. Fungsi penambahan H2SO4 yaitu untuk memberi suasana asam agar terjadi reaksi antara FeCl3 dengan KI. Kemudian larutan tersebut ditambahkan larutan KI dan masih terbentuk warna kuning. Setelah itu larutan dipanaskan sebentar. Pemanasan bertujuan untuk mempercepat reaksi, karena kenaikan suhu dapat mempercepat tumbukan partikel sehingga dapat mempercepat pencapaian energy aktivasi. Setetah itu ditambahkan amilum dan terjadi perubahan warna menjadi hijau tua. Hal ini menunjukkan adanya I2 dalam reaksi redoks, karena fungsi penambahan amilum yaitu sebagai indikator untuk mengetahui adanya I2. KI berfungsi sebagai indicator adanya amilum.
Dilihat dari reaksi
di atas, terlihat bahwa hidrogen pada HCl mengalami reduksi dari biloks +1
menjadi 0 dan HCl sebagai oksidator. Iodin pada KI mengalami oksidasi dari
biloks -1 menjadi 0 dan KI sebagai reduktor.
DAFTAR PUSTAKA
Basri,S.,2003,Kamus Kimia,Rineka Cipta,Jakarta
Brady,1994,Kimia Universitas Asas dan Struktur,Erlangga,Jakarta
Chang,R.,2005,Kimia Dasar Jilid 2,Erlangga,Jakarta
Fessenden,J.R.,1995,Kimia Organik,Erlangga,Jakarta
Keenan,1986,Ilmu Kimia Untuk Universitas,Erlangga,Jakarta
Miller,1987,Chemstry a Basic Introduction, Wadshot Publishing Company,USA
Parker,S.,1986,Chemical Terms,mc graw hill book Company, New York
Petrucci,1992,Kimia Dasar,Erlangga,Jakarta
Rivai,H.,1995,Asas Pemeriksaan Kimia,UI Press,Jakarta
Svehla,1985,Analisis Anorganik Makro dan Semimikro,PT.Kalman Media Pustaka,Jakarta
Download Link
Recomended Post
Semoga Bermanfaat dan jika ada pertanyaan silahkan tanyakan pada coloumb Komentar ataupun menghubungi admin.
Tag :
Praktikum




























1 Komentar untuk "PERCOBAAN VIII REAKSI REDOKS (Kimia Dasar II)"
Berapa takaran yg pas untuk h2o2 dg soda coustik dan asam citrat untuk 1 ltr h2o2 dan berapa liter airnya