SENYAWA
BIO-ORGANIK : KARBOHIDRAT
I.
Tujuan
Percobaan
1.1.
Mampu menjelaskan sifat umum dan sifat khusus karbohidrat.
1.2.
Mampu melakukan analisis kualitatif karbohidrat dalam
suatu sampel.
II. Tinjauan Pustaka
2.1
Karbohidrat
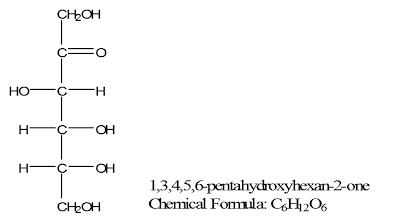
Karbohidrat adalah polihidroksi aldehid atau polihidroksi keton yang mempunyai rumus umum Cn(H2O)m, dimana n sama dengan m atau kelipatan bilangan bulat. Karbohidrat merupakan senyawa-senyawa hasil fotosintesis tumbuhan yang berklorofil :
Karbohidrat
merupakan sumber energi utama yang diperlukan oleh tubuh manusia, bila
kelebihan karbohidrat maka karbohidrat akan disimpan sebagai glikogen dan asam
lemak.
(Respati,
1980)
2.1
Penggolongan
Karboidrat
1.1.1
Monosakarida
Monosakarida adalah karbohidrat yang sederhana,
molekulnya tidak dapat diuraikan. Monosakarida yang paling sederhana adalah
gliserol dehid dan dihidroksi aseton.
(Poedjiadi, 1994)
Berdasarkan
radikal fungsinya, monosakarida dibedakan menjadi:
1.
Aldosa
Aldosa adalah
monosakarida yang mengandung gugus aldehid.
Contoh : glukosa dan galaktosa
2.
Ketosa
Ketosa adalah
monosakarida yang mengandung gugus keton.
Contoh : fruktosa
(Poedjiadi, 1994)
Pembagian Monosakarida
a.
Glukosa
Sering disebut dekstrosa karena mempunyai sifat
dapat memutar cahaya terpolarisasi ke arah kanan. Banyak terdapat di buah dan madu.
(Poedjiadi, 1994)
a.
Galaktosa
Umumnya berikatan dengan glukosa dalam bentuk
laktosa yaitu gula yang terdapat dalam susu. Galaktosa mempunyai rasa kurang
manis daripada glukosa dan kurang larut dalam air. Galaktosa mempunyai sifat
memutar bidang cahaya terpolarisasi ke kanan.
(Poedjiadi, 1994)
a.
Fruktosa
Sering disebut levolusa karena memutar bidang
polarisasi ke kiri. Fruktosa adalah gula termanis, terdapat dalam buah dan
madu, maupun dalam sukrosa. Fruktosa
mempunyai sifat seperti keton karena mengandung gugus keton.
Sifat-sifatnya :
-
Mempunyai gugus keton (karbonil) bebas disamping gugus hidroksil
bebas
-
Dapat terhidrasi jika dipanaskan bersama asam mineral
kuat
-
Dapat mereduksi fehling dan menghasilkan endapan merah
bata.
(Kleinfelter, 1990)
(Poedjiadi, 1994)
1.1.1
Disakarida
Disakarida
terbentuk dari dua monosakarida dengan menghubungkan ikatan glikosida diantara
anometrik dari salah satu monosakarida dengan gugus hidroksil monosakarida
lain. Hidrolisa disakarida dengan pengaruh
asam-asam mineral encer akan menghasilkan monosakarida-monosakarida penyusun
disakarida.
Disakarida
dapat di bagi menjadi 4, yaitu :
a.
Maltosa
Maltosa adalah hasil reaksi glukosa dan glukosa,
yang diperoleh sebagai hasil hidrolisi pati. Karbon anomerik dari unit glukosa
yang kedua berbentuk hemiasetal, fungsinya berbeda dalam kesetimbangan dengan
bentuk aldehid rantai terbuka, karena itu maltose memberikan hasil positif
dengan uji tollens dan reaksi lain yang serupa berlaku untuk karbon anomerik
pada glukosa. Strukturnya :
(Fessenden, 1982)
a.
Laktosa
Hidrolisis laktosa menghasilkan glukosa dan galaktosa
dalam jumlah yang sama. Kristal anomer α (pada unit glukosa) dibuat komersial dalam keju. Laktosa
dapat mereduksi pereaksi fehling dan benediet pada pemanasan.
(Hart, 1988)
Strukturnya :
(Poedjiadi, 1994)
a.
Sukrosa
Tersusun oleh glukosa dan fruktosa dalam jumlah yang
sama.
Strukturnya :
(Poedjiadi,
1994)
Dari struktur ini maka sukrosa
tidak akan mengalami metarotasi, hidrolisa menjadi glukosa dan fruktosa dapat
terjadi oleh adanya asam kemudian diikuti dengan terjadi perubahan pemutaran
bidang polarisasi cahaya, peristiwa ini dikenal sebagai inverse sukrosa.
(Respati,
1982)
a.
Sellebiosa
Desakarida yang diperoleh diperoleh dari
hidrolisis parsial selulosa. Hidrolisis lebih lanjut menghasilkan glukosa, oleh
karena itu selebrosa adalah isomer dari maltose. Struktur konformasi yang
digambarkan pada selebrosa ialah satu cincin mengandung oksigen yang berurutan
satu di belakang yang lainnya.
(Fessenden, 1982)
1.1.1
Polisakarida
Polisakarida
adalah senyawa yang tersusun dari molekul-molekul monosakarida yang
dipersatukan dengan ikatan glukosida. Hidrolisis yang lengkap akan dapat dihasilkan
monosakarida-monosakarida penyusun polisakarida. Polisakarida memenuhi 3 maksud dalam sistem kehidupan, yaitu :
a.
Sebagai bahan bangunan :
sellulosa dan kitin
b.
Sebagai bahan makanan : pati
dan glikogen
c.
Sebagai zat spesifik :
polisakarida heparin
(Fessenden,
1982)
Pembagian polisakarida
a.
Sellulosa
Merupakan senyawa organik yang paling melimpahdi
bumi. Sellulosa membentuk komponen serat dari dinding sel tumbuhan. Molekul
sellulosa merupakan rantai-rantai dan D-glukosa sebanyak 14000 satuan yang
terdapat sebagai berkas-berkas mirip tali yang terikat satu sama lain oleh
ikatan hidrogen. Sellulosa tidak mempunyai hemiasetal sehingga tidak dapat
mengalami dioksidasi oleh reagen seperti tollens.
(Fessenden, 1982)
Sellulosa terdapat
dalam tumbuhan sebagai bahan pembentuk dinding sel. Contoh : serat kapas. Dalam
tubuh kita, serat tidak dapat dicerna karena kita tidak mempunyai enzim yang
dapat mengurangi sellulosa.
(Poedjiadi,
1994)
a.
Pati (amilum)
Merupakan polisakarida paling melimpah kedua. Pati dapat
di pisahkan menjadi dua fraksi utama berdasarkan kelarutan bila di titurasi
dengan air panas sekitar 20%. Pati adalah 20% amilosa (larut) dan 80% sisanya
adalah amilopektin (tidak larut).
1)
Amilosa
Hidrolisis amilosa menghasilkan D-glukosa, hidrolisis
parsial menghasilkan maltosa. Timbul warna biru tua dan timbul interaksi antar
keduanya.
2)
Amilopektin
Mengandung 1000 satuan glukosa atau lebih permolekul hidrolisis
amilopektin.
3)
Glikogen
Yaitu polosakarida yang di gunakan sebagai tempat
penyimpanan glukosa dalam sistem hewan. Struktur glikogen mirip amilopektin,
bedanya untuk glikogen rantainya lebih bercabang daripada amilopektin.
4)
Kitin
Polisakarida linear yang mengandung
N-asetil-o-glukosamina terikat pada hidrolisis. Kitin menghasilkan
2-amina-2-deoksi-o-glukosa (gugus asetat terlepas dalam tahap hidrolisis). Di
alam, kitin terikat pada bahan bukan polisakarida (protein dan lipid).
(Fessenden,1982)
2.1
Sifat-Sifat
Umum Monosakarida
1.1.1
Reaksi
Oksidasi
Hasil oksidasi
tergantung dari kuat tidaknya oksidator yang dipakai pada oksidasi aldosa dengan oksidator
lemah, contoh : aqua bromata akan didapatkan asam hidroksi monokarboksilat yang
disebut asam aldonat.
(Sumardjo, 1997)
1.1.2
Reaksi
Reduksi
Pada reaksi reduksi monosakarida dengan sedium
amolgen berbentuk polialkohol yang namanya mendapat akhiran “atol”.
Reduksi asam aldonat dengan sedium amolgen akan
menghasilkan asam yang namanya berakhiran uronat. Asam uronat mempunyai sebuah
radikal formil pada ujung bagian atas dan radikal hidroksil di bagian tengah
dan sebuah karboksil pada ujung bagian bawah.
(Sumardjo, 1997)
1.1.1
Reaksi
Dehidrasi
Heksosa dan
beberapa pentose dapat mengalami proses dehidrasi yang dipengaruhi oleh asam mineral
kuat pada pemanasan dan akan diperoleh dehidrasi pentose fulforal atau
furaldehid. Sedangkan dehidrasi
heksosa hidroksil metal fulforal/hidroksi metal fur aldehida.
(Sumardjo, 1997)
2.2
Sifat-Sifat
Umum Disakarida
·
Maltosa dan laktosa dapat merduksi larutan fehling atau
tollens.
·
Sukrosa tidak dapat mereduksi larutan fehling atau
tollens.
Dapat dihidrolisis (pemecahan) menjadi molekul
monosakarida penyusunnya:
(Sumardjo,
1997)
2.1
Sifat-Sifat Umum Polisakarida
·
Glikogen
dapat mereduksi fehling dan apabila direaksikan dengan iodine maka akan berubah
menjadi merah coklat.
·
Amilum
tidak dapat mereduksi fehling dan apabila direaksikan dengan iodine maka akan
terbentuk amilum yang berwarna lain.
(Gibson, 1950)
2.2
Uji
Pengenalan Karbohidrat
1.2.1
Uji
Fehling
Pereaksi ini dapat direduksi selain karbohidrat yang
mempunyai sifat mereduksi. Fehling ada 2 macam :
-
Fehling
A : larutan cuprisulfat
-
Fehling
B : larutan NAOH, kNatartrat
Apabila dicampur dengan karbohidrat maka akan membentuk
endapan Cu2O berwarna merah bata.
(Holmi Comp,
1964)
1.2.2
Uji
Benedict
Pereaksi ini berupa larutan yang mengandung
cuprisulfat (CuSO4), Natrium Karbonat (NOCO3), dan
Natrium sulfat (Na2SO4). Jika karbohidrat ditambah dengan
benedict akan menyebabkan oksidasi karbohidrat menjadi asam aklamat, sedangkan
pereaksi benedict tereduksi dan menhasilkan endapan merah bata (Cu2O).
(Holmi
Comp, 1964)
1.2.3
Uji
Tollens
Tollens merupakan suatu larutan basa dari ion
kompleks perak amonia yang digunakan sebagai reagensia uji aldehid.
Diperoleh dari larutan perak nitrat dengan ammonium
hidroksida berlebihan.
(Holmi
Comp, 1964)
1.2.4
Uji
Asam Pikrat
Asam pikrat jenuh berwarna kuning. Positif jika terjadi
perubahan warna kuning menjadi merah. Uji ini untuk
mengetahui sifat pereduksi karbohidrat.
(Lucas, 1935)
1.2.5
Uji
Hidrolisis
Uji hidrolisis untuk mengetahui/memisahkan penyusun
dari disakarida atau polisakarida yang tersusun dari monosakarida-monosakarida.
(Holmi Comp, 1964)
1.2.6
Uji
Molisch
Sampel ditambah noftol dan H2SO4,
jika sampel mengandung karbohidrat, akan terbentuk cincin merah pada bidang
batas.
(Holmi
Comp, 1964)
1.2.7
Uji
Selliwanorf
Pereaksi sel iwanorf adalah resolsinol (l,3)
hidroksi-benzena dalam asam klorida. Apabila karbohidrat direaksikan dengan
pereaksi sel iwanorf lalu dipanaskan dan membentuk warna merah anggur maka hal
ini menunjukkan adanya fruktosa.
(Holmi
Camp, 1964)
1.2.8
Uji
Kompleks Iodine-Kanji
Perubahan warna setelah ditetesi iodine menjadi biru
tua menunjukkan adanya karbohidrat. Hal ini terjadi karena molekul amilosa yang
membentuk senyawa berupa larutan koloid (amilopeksin).
(Holmi Comp, 1964)
2.3
Analisa
Bahan
1.3.1
Glukosa
Mudah larut dalam air, sukar larut dalam alcohol, memutar
cahaya terpolarisasi ke kanan.
(Basri,
1996)
1.3.2
Galaktosa
Kurang larut dalam air, sukar larut dalam eter dan
alcohol, kurang manis, memutar cahaya terpolarisasi ke kanan.
(Basri,
1996)
1.3.3
Fruktosa
Rasa paling manis, memutar cahaya terpolarisasi ke kiri,
dapat mereduksi peraksi fehling dan tollens.
(Basri,
1996)
1.3.4
Maltosa
Mereduksi
pereaksi benedict, fehling rasa manis, mengalami metarotasi gula pereduksi.
(Basri,
1996)
1.3.5
Laktosa
Rasa kurang manis, tidak larut dalam alkohol dan eter.
(Basri,
1996)
1.3.6
Sukrosa
Sukar larut dalam eter dan alcohol, larut dalam air,
tidak dapat mereduksi fehling, tidak mempunyai gugus hemiasetol, tidak
menunjukkan metarotasi.
(Basri, 1996)
1.3.7
Air
Suling
Air yang diperoleh dari pengembangan uap air melalui
proses penguapan. Tidak berwarna, bersifat polar,
pelarut organik yang baik.
(Amirudin,
1993)
1.3.8
Iodine
Sukar larut dalam air, mudah larut dalam klorofom astal,
larut dalam minyak gliserol.
(Amirudin,
1993)
1.3.9
Madu
Madu lebah sebagian besar mengandung gula inverse. Gula
inverse banyak digunakan untuk es krim dan permen. Gula inverse rasanya paling
manis dari sakarida lainnya.
(Amirudin,
1993)
1.3.10 Sirup
Sirup glukosa yaitu larutan glukosa yang sangat
pekat, seningga mempunyai viskosilas/kekentalan yang tinggi, didapat dari
amilum melalui proses hirolisis dengan asam.
(Basri, 1996)
1.3.11 NaOH
Larut dalam air dan etanol, tidak larut dalam eter,
sebagai basa untuk membuat sabun dan kertas.
(Basri, 1996)
1.3.12 Pereaksi Fehling
Pereaksi ini terdiri atas campuran larutan tembaga
sulfat, kalium natrium tantriat dan natrium hidroksida. Larutan fehling A
adalah larutan CuSO4 dalam air, larutan B adalah larutan garam KNa
tartriat dan NaOH dalam air.
(Pudjaatmaka,
1999)
1.3.13 Pereaksi Molisch
Terdiri atas larutan α-naftol dan asam sulfat,
bereaksi positif dengan karbohidrat jika mengahsilkan warna merah.
(Pudjaatmaka,
1999)
1.3.14 H2SO4
Bersifat higroskopis, dalam larutan cair bersifat
asam kuat, dalam keadaan pekat bersifat oksidator dan zat pendehidrasi.
(Sumardjo,
1997)
1.3.15 Amilum
Suatu polisakarida sebagai hasil polimersi alam dari
molekul kecil karbohidrat dengan rumus C6H10O5,
sebagai butiran dalam berbagai ukuran dan menjadi cirri dari sel tumbuhan.
(Sumardjo,
1997)
1.3.16 Benedict
Berupa larutan yang mengandung cuprisulfat, natrium karbonat
dan natrium sitrat. Jika direaksikan dengan aldehid dan dipanaskan akan
mengendap menjadi Cu2O.
(Sumardjo,
1997)
1.3.17 Pereaksi Tollens
Jika direaksikan dengan monosakarida yang mengandung
gugus aldehid akan mengahsilkan cermin perak. Pereaksi tollens dibuat dengan
mencampurkan larutan perak nitrat dan natrium hidroksida.
(Amirudin,
1993)
1.3.18 HNO3
Merupakan asam anorganik, zat cair tidak berwarna,
bersifat korosit dan oksidator kuat.
(Amirudin, 1993)
1.3.19 Pereaksi Sel iwanorf
Pereaksi sel iwanorf apabila direaksikan dengan
karbohidrat lalu dipanaskan akan terbentuk warna merah anggur.
(Amirudin, 1993)
1.3.20 Asam Pikrat
Rasa pahit, sukar larut dalam air, larut dalam
alcohol, eter dan zat pelarut organic lain. Reaksi dengan logam-logam membentuk
garam pikrat.
(Pudjaatmaka,
1999)
1.3.21 Etanol
Cairan jenuh tek berwarna, mudah terbakar, mudah
bercampur dengan air. Rumus kimia C2H5OH digunakan
sebagai pelarut, bahan bakar, antiseptic (alcohol 70%), bahan minuman keras,
dan juga sebagai bahan mentah dalam beberapa industry kimia.
(Basri, 1996)
1.3.22 Na2CO3
Menyebabkan iritasi kulit,
menyebabkan gangguan kelenjar lendir.
(Basri, 1996)
II.
Metode
percobaan
3.1 Alat
1.
Tabung
reaksi 6. kertas saring
2.
Gelas
ukur 7. Bunsen&kaki
tiga
3.
Pengaduk 8. kaca arloji
4.
Penjepit 9. pipet tetes
5.
Gelas
beker
3.2 Bahan
1.
glukosa 8. air suling 15. H2SO4
2.
pereaksi
asam pikrat 9. madu 16. HCl
3.
Galaktosa 10. HNO3 17. NaOH
4.
Pereaksi sel iwanorf 11. Na2CO3 18. pereaksi tollens
5.
Fruktosa
12. pereaksi fehling 19. pereaksi molish
6.
Maltose 13. pereaksi benedict 20. Sukrosa
7.
Etanol 14. Kanji 21. sirup
3.4 Skema kerja
3.4.1
Uji Kelarutan
a.
Uji dengan Aquadest
IV. DATA PENGAMATAN
No.
|
Jenis Uji
|
Hasil
|
Ket
|
1.
2.
3.
4.
5.
|
Uji kelarutan
a.
Uji
dengan H2O
a.
Glukosa
b.
Fruktosa
c.
Maltose
d.
Laktosa
e.
Sukrosa
f.
Kanji
b.
Uji
dengan etanol 25 %
c.
Glukosa
d.
Fruktosa
e.
Maltose
f.
Laktosa
g.
Sukrosa
h.
Kanji
Uji Fehling
a.
1
ml laktosa
b.
1
ml glukosa
c.
1
ml sukrosa
d.
1
ml fruktosa
e.
1
ml kanji
f.
1
ml madu
g.
1
ml sirup 2%
Hidrolisa disakarida dan polisakarida
a.
Uji
kompleks kanji iodine
larutan kanji 1 % + 1 tetes iodine encer
b.
Uji
hidrolisis
§ 2 mL dan 1 mL
larutan kanji 2 % + 2 tetes HCL pekat, pemanasan
§ Ditambah 1 tetes iodine
encer, pengecekan dengan lakmus
§ Ditambah NaOH 10
%
§ Ditambah 5 mL
fehling + dipanaskan
Tes Umum Terhadap Karbohidrat
a. Uji Molisch
§ Glukosa
§ Fruktosa
§ Maltose
§ Madu 50%
§ Potongan kertas saring
Tes
Karbohidrat Pereduksi
a. Uji Benedict
§ Glukosa
§ Fruktosa
§ Maltose
§ Laktosa
b. Uji asam pikrat
§ Glukosa
§ Fruktosa
§ Maltose
§ Laktosa
c. Uji Tollens
§ Glukosa
§ Fruktosa
§ Maltose
§ Laktosa
d. Uji selliwanorf
§ Glukosa
§ Fruktosa
|
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening
Warna larutan
menjadi bening, terdapat endapan putih
Warna larutan
dari biru setelah ditambah fehling menjadi orange setelah dipanaskan ada endapan merah bata
Warna larutan
dari biru setelah ditambah fehling menjadi orange setelah dipanaskan ada endapan merah bata
Warna larutan
dari biru setelah ditambah fehling menjadi orange setelah dipanaskan ada endapan merah bata
Warna larutan
setelang ditambah fehling menjadi biru tetapi setelah dipanaskan tidak
berubah
Warna larutan
dari biru setelah ditambah fehling menjadi orange setelah dipanaskan ada endapan merah bata
Warna larutan
dari biru setelah ditambah fehling menjadi orange setelah dipanaskan ada endapan merah bata
Warna larutan
dari biru setelah ditambah fehling menjadi orange setelah dipanaskan ada endapan merah bata
Warna larutan
menjadi biru tua
Larutan menjadi
lebih keruh
Larutan menjadi
berwarna biru, lakmus berwarna merah
Warna larutan menjadi
bening dan kertas lakmus menjadi biru muda
Warna larutan
tetap tidak terjadi perubahan
Terbentuk cincin
ungu
Terbentuk cincin
ungu
Terbentuk cincin
ungu
Terbentuk cincin
ungu
Terbentuk cincin
ungu
Terbentuk endapan
merah bata
Terbentuk endapan
merah bata
Terbentuk endapan
merah bata
Terbentuk endapan
merah bata
Larutan berwarna
kuning
Larutang berwarna
kuning kemerahan
Larutan berwarna
kuning
Larutan berwarna
kuning
Warna larutan
orange pucat terdapat endapan coklat
Warna larutan
orange pucat terdapat endapan coklat
Warna larutan
kuning pucat
Warna larutan
kuning pucat
Warna larutan
tidak berwarna (bening)
Warna larutan
coklat kemerahan
|
+
+
+
+
+
+
+
+
+
+
+
-
+
+
+
-
+
+
+
+
-
+
+
+
+
+
+
+
+
+
-
+
-
-
+
+
-
-
-
+
|
I.
Pembahasan
5.1 Uji Kelarutan
5.1.1 Uji dengan air
Percobaan ini
dimaksudkan untuk mengetahui tingkat kelarutan karbohidrat di dalam air.
Karbohidrat yang digunakan sebagai sampel yaitu glukosa, laktosa, fruktosa,
maltosa, sukrosa, dan kanji.
Langkah kerja
yang dilakukan yaitu sampel diencerkan dengan aquades atau air suling untuk
mengetahui kelarutannya, kemudian digojog. Tujuan dari penggojogan ini yaitu
untuk mencampurkan agar karbohidrat bercampur sempurna dengan air. Hasil yang
diperoleh adalah larutan menjadi lebih bening atau bernilai positif.
Karbohidrat
dapat larut dalam air, hal ini dikarenakan sifat karbohidrat sesuai prinsip “like
dissolve like” yaitu senyawa polar akan melarutkan senyawa polar dan
senyawa non polar akan melarutkan senyawa non polar.
Karbohidrat merupakan larutan polar, dan air juga merupakan senyawa polar
sehingga bila dicampur karbohidrat akan larut. Sebelum di larutkan, warna
karbohidrat (glukosa, galaktosa, fruktosa, maltosa, manosa, laktosa, sukrosa)
warna jernih kekuningan. Setelah di larutkan menjadi jernih karena adanya
proses pengenceran yang menyebabkan molaritas dari zat terlarut berkurang,
sehingga kepekatan warnanya juga berkurang dan larutan tampak jernih.
5.1.2
Uji dengan etanol
Selain air, etanol juga merupakan pelarut yang baik. Percobaan ini
bertujuan untuk mengetahui kelarutan karbohidrat dalam etanol 25%. Sebagaimana
dalam uji kelarutan dengan air, sampel yang digunakan juga sama.
Langkah yang dilakukan pun juga sama yaitu dengan menambahkan sampel dalam
etanol 25% kemudian digojog. Hasil yang diperoleh menunjukkan hasil yang
positif yaitu larutan menjadi lebih jernih kecuali larutan kanji karena kanji
mengendap. Hal ini dikarenakan kanji terdiri atas dua macam polisaksarida yaitu
amilosa dan amilopektin, molekul amilopektin lebih besar daripada amilosa
sehingga amilopektin lebih susah larut.
Karbohidrat larut dalam air dan etanol, perbedaan kelarutan antar keduanya
yaitu etanol membutuhkan waktu yang lebih lama dan penggojogan yang lebih kuat.
Hal ini dikarenakan kepolaran etanol lebih kecil dari kepolaran air. Hal ini
sesuai juga dengan Daintith (1994) “karbohidrat lebih mudah larut dalam air
daripada di larutkan ke dalam etanol karena tingkat kepolaran air lebih besar
daripada etanol”.
5.2 Uji fehling
Untuk mengetahui sifat reduktor pada karbohidrat dapat dilakukan dengan uji
fehling. Sampel yang digunakan dalam uji ini yaitu glukosa, fruktosa, laktosa,
sirup, madu dan kanji.
Cara kerja yang dilakukan yaitu dengan menambahkan perekasi fehling yang
terdiri dari fehling A yaitu larutan CuSO4 dan fehling B yang
terdiri dari K-Na-tartrat dan NaOH, kemudian dipanaskan sambil digoyang.
Pemanasan dan penggoyangan yang dilakukan bertujuan untuk mempercepat
terjadinya reaksi, dengan pemanasan maka suhu larutan akan naik, sehingga
mengakibatkan gerakan-gerakan molekul dalam larutan semakin cepat dan terjadi
tumbukan antar molekul yang semakin besar.
Karbohidrat pereduksi akan diubah menjadi asam onat yang membentuk garam karena
adanya basa, sedngkan pereduksi fehling akan mengalami reduksi sehingga tembaga
(II) berubah menjadi tembaga (I).
Hasil yang diperoleh dari uji ini adalah positif yaitu terbentuk endapan
merah bata. Endapan merah bata tersebut adalah endapan dari Cu2O.
Hasil positif uji fehling akan terbentuk endapan warna merah yang
menunjukkan karbohidrat yang di uji mempunyai sifat pereduksi. Bahan-bahan yang
di uji,seperti glukosa, kanji, laktosa, sirup, madu, terjadi perubahan warna
dan terbentuk endapan warna merah bata, kecuali fruktosa. Fruktosa merupakan gugus ketosa yang tahan terhadap
oksidator, sedangkan pada uji fehling akan di uji daya oksidasi dan reduksi
dari suatu karbohidrat, sehingga fruktosa tidak mengalami perubahan warna.
(Sumardjo,
2009)
5.3 Uji
Hidrolisa Disakarida dan Polisakarida
a.Uji Kompleks
Kanji Iodine
Tujuan dari uji ini adalah untuk mengetahui adanya karbohidrat yang
terkandung pada kanji. Percobaan yang dilakukan pada uji ini adalah penambahan
10 tetes larutan kanji 1% yang diletakkan pada gelas arloji untuk mengetahui
apakah ditambahkan 1 tetes larutan iodine encer. Di dalam pati dipisahkan menjadi dua fraksi utama yaitu amilosa dan
amilopektin. Penambahan iodien bertujuan untuk mengetahui adanya amilosa pada
suatu sampel. Molekul amiloas membentuk spiral di sekitar molekul I2
yang menyebabkan timbul warna biru tua dari antaraksi antara keduanya, yang
menunjukkan hasil positif dari uji ini.
b.Uji
Hidrolisis
Tujuan dari uji ini adalah untuk mengetahui atau memisahkan penyusun dari
disakarida atau polisakarida yang tersusun dari monosakarida-monosakaridanya.
Percobaan yang dilakukan pada uji ini adalah dengan larutan kanji 2%
ditambahkan dengan larutan HCl pekat, larutan menjadi agak keruh. Penambahan HCl pekat bertujuan untuk memecah rantai
amilum/pati yang merupakan polisakarida menjadi monosakarida. Pati merupakan
polimer linier dari glukosa sehingga hidrolisis sempurna dari pati akan
menghasilkan glukosa.
Langkah selanjutnya adalah pemanasan, tujuan dari pemanasan ini untuk mempercepat reaksi hidrolisis. Setelah dipanaskan, larutan ditambah 1 tetes
iodine untuk menguji masih ada atau tidaknya amilosa.
Hasilnya larutan
menjadi berwarna biru tua yang
menunjukkan bahwa sampel masih mengandung amilosa (belum terhidrolisis secara
sempurna). Kemudian
di uji dengan kertas lakmus, warna
kertas menjadi merah yang menunjukkan larutan bersifat asam, kemudian dilakukan
penambahan NaOH 10% untuk menetralkan
sisa asam hingga
larutan tepat basa, warna larutan menjadi bening. Pati belum terhidrolisis secar sempurna, hal
ini dikuatkan oleh uji fehling yang
hasilnya negatif yaitu warna larutan masih berwarna biru muda.
(Sumardjo,
2009)
5.4 Uji Molish
Tujuan dari uji molish adalah untuk mengidentifikasi adanya kandungan
karbohidrat pada suatu sampel. Apabila sampel yang diuji dengan pereaksi molish
membentuk cincin warna ungu, berarti sampel tersebut mengandung karbohidrat. Sampel
yang dipakai yaitu glukosa, fruktosa, maltosa, madu 50% dan potongan kertas
saring.
Pada percobaan disiapkan 5 tabung reaksi. Masing-masing tabung diisi sampel
kemudian ditambah ditambah 3 ml H2SO4
dan 2 tetes alfa naftol. Penambahan H2SO4 ditujukan
untuk mendehidrasi karbohidrat agar menjadi hidroksimetilfurfural, dan
penambahan alfa naftol agar terbentuk senyawa khusus untuk polisakarida dan
disakarida. Pada tabung-tabung tersebut terbentuk tiga lapisan. Lapisan atas
berwarna bening, lapisan tengah terbentuk cincin warna ungu dan lapisan bawah
berwarna hijau. Pengecualian pada tabung reaksi yang berisi madu 50% yang
terbentuk dua lapisan. Lapisan atas berwarna ungu muda dan lapisan bawah
berwarna ungu pekat. Semua sampel menunjukkan hasil yang positif, hal ini
disebabkan karena karbohidrat mengalami hidrolisis oleh Asam Sulfat menjadi
Hidroksil metil Furtenol yang kemudian terkondensasi membentuk senyawa kompleks
berwarna ungu. Adanya penambahan H2SO4 pada uji ini
bertujuan untuk memprercepat reaksi (sebagai katalisator).
Contoh reaksi uji molish pada heksosa :
(Sumardjo,
2009)
5.5 Uji
Benedict
Tujuan dari uji benedict adalah unuk membuktikan sifat pereduksi pada
karbohidrat. Pada uji ini disiapkan 4 tabung, masing-masing tabung diisi dengan
larutan glukosa, fruktosa, maltosa dan laktosa kemudian ditambahkan 1ml larutan
pereaksi benedict, kemudian digojog lalu dipanaskan. Pereaksi benedict terdiri dari cuprisulfat, natrium
karbonat, dan natrium sitrat. Glukosa akan mereduksi ion Cu2+ dari
cupri sulfat menjadi ion Cu+ yang kemudian mengendap sebagai Cu2O.
Adanya natrium karbonat dan natrium sitrat membuat pereaksi bersifat basa
lemah. Endapan yang terbentuk dapat berwarna merah bata.
Perlakuan
penggojogan bertujuan
agar larutan menjadi homogen, sedangkan adanya pemanasan
supaya mempercepat reaksi. Hasil yang diperoleh dari semua tabung tersebut
mengalami perubahan warna yang sama, yang awal warna larutan berwarna bening kebiruan
menjadi larutan yang mempunyai endapan warna merah bata, hasil ini menunjukkan
nilai uji positif. Terbentuknya endapan
merah bata disebabkan oksidasi karbohidrat (gula pereduksi) menjadi Asam onat,
sedangkan pereaksi benedict tereduksi dan menghasilkan endapan Cu2O
(merah bata).
Contoh reaksi antara glokosa dan pereaksi
benedict :
(Sumardjo, 2009)
5.6 Uji Asam
pikrat
Tujuan dari uji benedict adalah unuk
membuktikan sifat pereduksi pada karbohidrat. Pada uji ini dibutuhkan 4 tabung,
masing-masing tabung diisi dengan larutan glukosa, fruktosa, maltosa dan
laktosa kemudian sama sama ditambahkan
larutan Asam pikrat dan larutan
HNO3 dan dipanaskan. Oksidasi karbohidrat menjadi asam onat dan
reduksi asam pikrat yang berwarna kuning menjadi asam pikramat yang berwarna
merah.
Hanya pada tabung yang berisi fruktosa yang mengalami perubahan warna dari
larutan yang berwarna kuning menjadi berwarna agak kemerahan, sedangkan pada
tabung yang lain tidak mengalami perubahan (hasil negatif). Perubahan warna
yang terjdi disebabkan adanya asam pikrat mengalami reduksi menjadi asam
pikramat.
Pada uji ini terjadi hasil negatif kecuali
pada tabung berisi fruktosa,ini mungkin dikarenakan reagen yang rusak atau
dikarenakan praktikan yang melakukan kesalahan dalam melakukan percobaan,sehingga
didapatkan hasil yang negatif.
Contoh
reaksi antara glukosa dan asam pikrat :
(Soemardjo,
2009)
5.7 Uji
Tollens
Uji tollens dilakukan dengan tujuan untuk mengetahui adanya gugus aldehid
dalam karbohidrat. Sebagai sampel dari percobaan ini adalah glukosa, fruktosa,
maltosa, dan laktosa. Percobaan dilakukan dengan penambahan pereaksi tollens
pada sampel dengan perbandingan 1 : 1.
Penambahan pereaksi tollens adalah sebagai oksidator yang akan direduksi Setelah itu larutan dipanaskan disertai penggoyangan yang
bertujuan untuk mempercepat reaksi. Setelah dilakukan pemanasan larutan diamati
terbentuknya endapan perak. Hasil yang diperoleh dari percobaan ini
adalah hasil yang positif yaitu terbentuk endapan perak, kecuali maltosa.
Contoh reaksi antara glukosa dan pereaksi
tollens :
(Soemardjo, 2009)
5.8 Uji
Selliwanorf
Uji selliwanorf dilakukan untuk membedakan antara gula aldosa dan ketosa.
Sampel dalam percobaan ini yaitu glukosa dan fruktosa, dan reagen yang digunakan adalah pereaksi selliwanorf,
pereaksi selliwanorf adalah resorsinol dalam asam klorida encer. Asam klorida
berfungsi untuk mendehidrasi glukosa dan resorsinol untuk reaksi kondensasi. Percobaan dilakukan dengan penambahan pereaksi
selliwanorf dan kemudian dilakukan pemanasan sekaligus penggoyangan. Pemanasan
dan penggoyangan dimaksudkan untuk mempercepat reaksi dan agar larutan
bercampur sempurna.
Hasil yang diperoleh dari percobaan ini yaitu setelah ditambah pereaksi
selliwanorf, fruktosa berwarna orange dan glukosa tetap bening, setelah
pemanasan, warna larutan fruktosa semakin merah tetapi glukosa tetap bening.
Hal ini menunjukkan nilai uji positif pada fruktosa dan negatif pada glukosa.
Jadi fruktosa merupakan gula ketosa.
Contoh reaksi antara glukosa dan selliwanorf :
(Soemardjo,
2009)
VI. Kesimpulan
6.1 Sifat
Fisik
Karbohidrat dapat larut dalam air dan etanol, karena
sama-sama senyawa polar, kecuali kanji karena kanji tersusun dari amilopektin
yang molekulnya besar.
6.2 Sifat Kimia
-
Kanji merupakan karbohidrat yang mempunyai kandungan
amilopektin yang dibuktikan dengan uji kanji iodine.
-
Untuk menguraikan polisakarida menjadi monosakarida
dilakukan uji hidrolisis.
-
Untuk mengidentifikasi adanya karbohidrat dalam sampel,
yang mengandung karbohidrat yaitu glukosa, fruktosa, maltosa, madu 50% dan
potongan kertas saring dilakukan uji mollish
-
Karbohidrat mempunyai sifat pereduksi.Hal ini dapat
dibuktikan dalam uji dengan fehling,benedict, asam pikrat, dan pereaksi
tollens.
-
Untuk mengidentifikasi perbedaan gula ketosa dan aldosa
dilakukan dengan uji selliwanorf.
DAFTAR
PUSTAKA
|
Amirudin. 1993. Kamus Kimia Organik. Jakarta:
Pusat Pembinaan dan Pengembangan Bahasa, DEPDIKBUD.
Basri, Sarjoni. 1996. Kamus Kimia. Jakarta: Rineka Cipta.
Daintith, John. 1994. Kamus
Lengkap Kimia. Jakarta: PT. Erlangga.
Fessenden,
Ralph J. 1982. Organic Chemistry. USA: Willard
Grant Press Publisher.
Gibson, Charles. 1950. Essential
Principles of Organic Chemistry. London: Chambridge of The University
Press.
Hart,
Harold. 1988. Kimia Organik – Suatu Kuliah Singkat. Jakarta: Erlangga.
Holmi Comp,
George K. 1964. Selected Experimental Organic Chemistry. San
Fransisco: William and Company.
Kleinfelter.
1990. Kimia untuk Universitas. Jakarta: PT. Erlangga
Lucas, Howard. 1935. Organic
Chemistry. New York: American Book Company.
Poedjiadi, Anna. 1994. Dasar-Dasar Biokimia. Jakarta: UI Press.
Pudjaatmaka.
1999. Kamus Kimia Organik. Jakarta: Depdikbud
Respati. 1980. Dasar-Dasar
Ilmu Kimia untuk Universitas. Jakarta: Aksara Baru.
Sumardjo,
Damin. 1997. Petunjuk Praktikum Kimia Dasar. Semarang:
Undip Press.
Sumardjo, Damin. 2009. Pengantar Kimia – Buku
Panduan Kuliah Mahasiswa Kedokteran. Jakarta: Penerbit Buku Kedokteran.
Download
.
Tag :
Praktikum




























0 Komentar untuk "PERCOBAAN VII SENYAWA BIO-ORGANIK : KARBOHIDRAT (Kimia Dasar I)"